Nome del prodotto:Metil etil chetone
Formato molecolare:C4H8O
Numero CAS:78-93-3
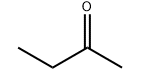
Struttura molecolare del prodotto:
Specifiche:
| Articolo | Unità | Valore |
| Purezza | % | 99,8 minuti |
| Colore | APHA | 8max |
| Valore di acidità (come acido acetico) | % | 0,002max |
| umidità | % | 0,03 massimo |
| Aspetto | - | Liquido incolore |
Proprietà chimiche:
Il metil etil chetone è suscettibile a varie reazioni a causa del suo gruppo carbonilico e dell'idrogeno attivo adiacente al gruppo carbonilico. La condensazione avviene quando riscaldato con acido cloridrico o idrossido di sodio per produrre 3,4-dimetil-3-esen-2-one o 3-metil-3-epten-5-one. Se esposto alla luce solare per lungo tempo, si formano etano, acido acetico e prodotti di condensazione. Genera diacetile quando ossidato con acido nitrico. Quando ossidato con agenti ossidanti forti come l'acido cromico, si genera acido acetico. Il butanone è relativamente stabile al calore e la scissione termica a temperature più elevate produce enone o metil enone. Quando condensato con aldeidi alifatiche o aromatiche, si formano chetoni ad alto peso molecolare, composti ciclici, condensazione chetonica e resine. Ad esempio, la condensazione con formaldeide in presenza di idrossido di sodio produce prima 2-metil-1-butanol-3-one, seguito dalla disidratazione a metacrilatone.
La resinizzazione avviene per esposizione alla luce solare o ai raggi UV. La condensazione con fenolo produce 2,2-bis(4-idrossifenil)butano. Reagisce con esteri alifatici in presenza di un catalizzatore basico per produrre β-dichetoni. Acilazione con anidride acida in presenza di un catalizzatore acido per formare β-dichetoni. Reagisce con acido cianidrico per formare cianidrina. Reagisce con ammoniaca per formare derivati della chetopiperidina. L'atomo di idrogeno α del butanone viene facilmente sostituito con alogeni per formare vari chetoni alogenati, come il 3-cloro-2-butanone, per interazione con il cloro. L'interazione con la 2,4-dinitrofenilidrazina produce 2,4-dinitrofenilidrazone giallo.
Applicazione:
Il metil etil chetone (2-butanone, etil metil chetone, metil acetone) è un solvente organico a tossicità relativamente bassa, presente in numerose applicazioni. Viene utilizzato in prodotti industriali e commerciali come solvente per adesivi, vernici e detergenti e come solvente decerante. Componente naturale di alcuni alimenti, il metil etil chetone può essere rilasciato nell'ambiente da vulcani e incendi boschivi. Viene utilizzato nella produzione di polvere senza fumo e resine sintetiche incolori, come solvente e nei rivestimenti superficiali. Viene anche utilizzato come sostanza aromatizzante negli alimenti.
Il MEK è utilizzato come solvente per vari sistemi di rivestimento, ad esempio vinilici, adesivi, nitrocellulosa e rivestimenti acrilici. È utilizzato in sverniciatori, lacche, vernici, vernici spray, sigillanti, colle, nastri magnetici, inchiostri da stampa, resine, colofonie, soluzioni detergenti e per la polimerizzazione. Si trova in altri prodotti di consumo, ad esempio cementi per uso domestico e hobbistico e prodotti per lo stucco del legno. Il MEK è utilizzato nella deceratura di oli lubrificanti, nello sgrassaggio dei metalli, nella produzione di pelli sintetiche, carta trasparente e fogli di alluminio, e come intermedio chimico e catalizzatore. È un solvente di estrazione nella lavorazione di alimenti e ingredienti alimentari. Il MEK può anche essere utilizzato per sterilizzare attrezzature chirurgiche e odontoiatriche.
Oltre alla sua produzione, le fonti ambientali di MEK includono i gas di scarico dei motori a reazione e a combustione interna e attività industriali come la gassificazione del carbone. Si trova in quantità sostanziali nel fumo di tabacco. Il MEK è prodotto biologicamente ed è stato identificato come un prodotto del metabolismo microbico. È stato trovato anche nelle piante, nei feromoni degli insetti e nei tessuti animali, ed è probabilmente un prodotto minore del normale metabolismo dei mammiferi. È stabile in condizioni normali, ma può formare perossidi in caso di conservazione prolungata; questi possono essere esplosivi.
Categorie di prodotti
-

Telefono
-

E-mail
-

WhatsApp
-

Superiore













